Os Modelos Atômicos
Os modelos atômicos surgiram da necessidade de um entendimento sobre a constituição da matéria. Filósofos gregos já concebiam a ideia de átomo, quando idealizaram que todo tipo de matéria era formada de minúsculas partes, e que poderiam ser divididas em pedaços cada vez menores, até chegar em uma partícula extremamente pequena, que seria indivisível. Daí veio o nome “átomo“. A palavra vem do grego, e quer dizer indivisível.
Até o final do século XIX, acreditava-se que realmente o átomo era a menor parte em que se poderia dividir a matéria. No entanto, hoje se sabe que o átomo se divide em partes ainda menores: as partículas subatômicas.
Os Modelos Atômicos e Seus Criadores
Ao longo do tempo, baseando-se em observações e experimentações, outros estudiosos foram criando novas teorias sobre esta partícula indivisível, criando os modelos atômicos. Veja abaixo quais foram esses modelos e quem foram os estudiosos que os criaram:
Modelo de Dalton
Em 1803 Dalton propôs o 1º modelo atômico, que ficou conhecido como “bola de bilhar“, onde observou que:
- O átomo é uma partícula minúscula, indivisível e não transformável. Átomos de um mesmo elemento apresentam propriedades semelhantes (forma, tamanho e massa).
- Cada composto químico apresenta uma proporção numérica de átomos (1:1, 1:2, 3:6, etc).
- Reações químicas nada mais são do que a reorganização de átomos.

Modelo de Dalton: esfera maciça
Modelo de Thomson
Em 1897, partindo de experiências realizadas em um tubo de raios catódicos, Thomson pôde formar sua teoria, onde dizia que:
- O átomo é uma esfera de carga positiva, incrustada de elétrons de carga negativa.
- As quantidades de cargas negativas e positivas são iguais. O átomo é neutro uniformemente.
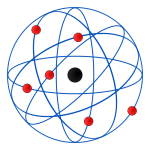
Modelo de Rutherford
Em 1911 o físico Ernest Rutherford fez uma série de experiências que consistiam basicamente em atingir uma lâmina metálica muito fina com um feixe de partículas alfa, que deveriam atravessá-la sem desviar de sua trajetória. Porém, observou-se que uma pequena quantidade destas partículas sofreu grande desvio na sua rota. Deste experimento Rutheford desenvolveu um novo modelo para o átomo, onde concluiu que:
- O átomo não seria uma esfera maciça, e sim uma estrutura com um núcleo muito pequeno, maciço e positivo, e ao seu redor, ocupando quase todo o volume do átomo, encontrava-se o que ele denominou de eletrosfera: um espaço vazio onde elétrons se movimentavam circundando o núcleo. Criou assim o modelo chamado planetário.
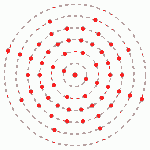
Modelo de Bohr
Em 1913, os estudos de Bohr surgiram basicamente para explicar porque os elétrons se movem ao redor do núcleo sem se chocar com ele. Em seus postulados ele afirma que:
- Os elétrons giram em órbita (chamadas também de camadas de energia) circular ao redor do núcleo e possuem um valor de energia determinado.Quanto mais distante do núcleo, maior a energia do nível.
- Ao receber ou perder energia, os elétrons podem “saltar” entre estas camadas.
- As propriedades químicas dos elementos eram determinadas pelos elétrons da camada mais externa.


parabéns pela sua explicação,gostei bastante e me ajudou muito também.
Ótima explicação, aliás tudo o que é colocado é muito bom e de muita utilidade para aluno de química.