Termoquímica
Em toda reação química existe uma troca de energia, ou seja, há liberação ou absorção de calor. A Termoquímica estuda esse calor liberado ou absorvido. A troca de energia do meio externo com os reagentes pode gerar emissão ou absorção de luz, de calor ou de eletricidade. Essas manifestações podem até provocar mudanças de estado físico nos componentes das reações.
A forma de se calcular o valor de um sistema é a Entalpia (ΔH). A variação da Entalpia está na diferença entre a entalpia dos produtos e a dos reagentes, sendo assim, o calor de uma reação corresponde ao calor liberado ou absorvido em uma reação.
ΔH = Hprod – Hreag
- Reação endotérmica: Hprod > Hreag , ΔH > 0
- Reação exotérmica: Hprod < Hreag , ΔH < 0
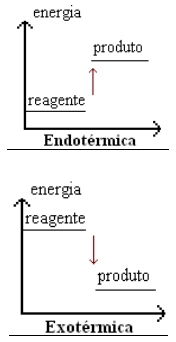
Reações exotérmicas e endotérmicas
As reações que liberam calor para o ambiente externo são denominadas reações exotérmicas. Já as reações que absorvem calor do meio externo são as reações endotérmicas.
Termoquímica
Exemplos:
- Um alimento que está sendo cozido sobre o fogo está passando por uma reação endotérmica.
- A reação de combustão que perde calor para o ambiente externo, é um exemplo de reação exotérmica.
Veja nos gráficos ao lado:
Entalpia de formação (ΔH°f)
É o calor liberado ou absorvido na formação de 1 mol de uma substância no estado-padrão, a partir de substância simples.
Entalpia de combustão (ΔH°C)
É o calor liberado na queima de 1 mol de uma substância no estado-padrão.