Ligações Químicas
Os átomos reúnem-se para formar as moléculas, que são a menor parte de uma determinada substância. Com exceção de algumas poucas substâncias cuja molécula possui um átomo apenas, todas as demais têm suas moléculas formadas pela união de dois ou mais átomos iguais (substâncias simples) ou diferentes (substâncias compostas). A molécula do gás oxigênio resulta da união de dois átomos do elemento oxigênio; a molécula da água tem dois átomos de hidrogênio e um de oxigênio; a molécula da sacarose (açúcar) é composta de 12 átomos de carbono, 22 de hidrogênio e 11 de oxigênio.
Os átomos mantêm-se unidos entre si por meio de forças de atração elétrica, semelhantes àquelas que fazem um pente eletrizado por atrito atrair pequenos pedaços de papel. Quando um átomo está isolado, seus elétrons movimentam-se em torno dele, atraídos pela carga elétrica do seu núcleo; quando dois ou mais átomos de aproximam, os elétrons passam a sofrer atração dos demais núcleos e suas órbitas se modificam, relacionando-se agora com os outros átomos. E isso faz com que eles se unam.
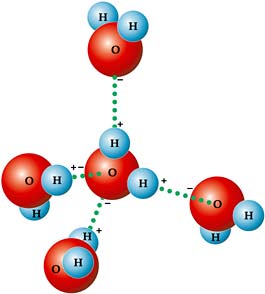
Exemplo de ligações químicas
Uma ligação química envolve pelo menos dois elétrons. O carbono, por exemplo, para formar o gás metano, junta cada um dos quatro elétrons mais externos com o único elétron de quatro átomos de hidrogênio. Se os dois elétrons assim emparelhados sofrem igual influência dos dois átomos a que pertenciam, a ligação recebe o nome de covalente. Este tipo de ligação, que ocorre no metano, mantém os átomos fortemente unidos. Quando um dos átomos perde o seu elétron em benefício do outro, a ligação é iônica. este tipo de ligação não é tão forte como o precedente. Basta dissolver a substância em água e os átomos separam-se sob a forma de íons, como acontece com o cloreto de sódio.