Estrutura Atômica: Dalton, Thomson, Rutherford e Bohr
A palavra átomo vem do grego, e quer dizer indivisível. Até o final do século XIX, acreditava-se que o átomo era a menor parte em que se poderia dividir a matéria. No entanto, hoje se sabe que o átomo se divide em partes ainda menores: as partículas subatômicas.
Os átomos foram objeto de estudo de diversos pensadores da Antiguidade, tais como Parmênides, Demócrito e Aristóteles. Até o século XVI, prevaleceu a teoria aristotélica. Para Aristóteles a matéria era contínua, ou seja, vista como um todo. Essa teoria se contrapunha à ideia de que a matéria era composta por minúsculas partículas indivisíveis.
No período moderno novas teorias atômicas foram elaboradas, até chegarmos no que conhecemos hoje. Vejamos a evolução dos modelos atômicos.
Modelo de Dalton ou Bola de Bilhar (1808)
No início do século XIX, baseado nas leis ponderais de Lavoisier e Proust, o químico John Dalton definiu que os átomos eram minúsculas partículas indivisíveis e indestrutíveis. Seu modelo ficou conhecido como “bola de bilhar”, por representar o átomo como uma esfera maciça. Segundo o químico inglês, os átomos de um mesmo elemento químico são idênticos.
Modelo de Thomson ou Pudim de Passas (1897)

Modelo de Thomson (“Pudim de Passas”)
Já no final do século XIX, baseado em experiências com cargas elétricas, o físico inglês J. J. Thomson mostrou que a teoria dos átomos indivisíveis estava equivocada e propôs um modelo conhecido como “pudim de passas”. O nome se explica pela representação do átomo segundo o físico. Para ele, o átomo seria uma esfera de carga positiva (pudim) que contém corpúsculos de carga negativa (passas) distribuídos uniformemente por todo o corpo. Os corpúsculos, imaginados por Thomson, ficaram conhecidos posteriormente como elétrons.
Modelo de Rutherford ou Modelo Planetário (1911)
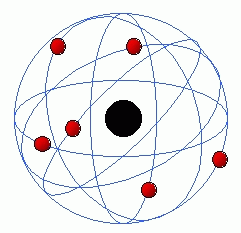
Modelo de Rutherford (“Modelo Planetário”)
Pouco depois de Thomson, o físico Ernest Rutherford demonstrou através de pesquisas utilizando a radioatividade que o raio do átomo era 10.000 vezes maior que o núcleo. Surgia, assim, o modelo nucleado de átomo, também conhecido como “modelo planetário”. Para Rutherford, o átomo é constituído por um núcleo positivo, que é neutralizado por uma região negativa, denominada eletrosfera. E ao seu redor, assim como os planetas, que giram em órbita, se encontram os elétrons, que se movimentam em torno de um núcleo atômico.
Modelo Rutherford-Bohr (1913)
Niels Bohr deu sequência aos trabalhos de Ernest Rutherford. Ele observou que o modelo planetário proposto apresentava dois grandes equívocos:
- uma carga negativa, colocada em movimento ao redor de uma carga positiva, adquire movimento espiralado em direção à carga positiva, colidindo contra ela;
- uma carga negativa em movimento perde energia, emitindo radiação. No entanto, o átomo, em seu estado normal, não emite radiação.
Por isso, Borh buscou soluções para essas falhas. Para tanto, o físico definiu que o átomo é eletricamente neutro e que nele predominavam espaços vazios. Em sua teoria, os elétrons descrevem trajetórias circulares ao redor do núcleo, com energia constante.

Muito resumido, muito mesmo. Nunca conseguiriam ensinar realmente uma pessoa com um conteúdo tão resumido, precisa de mais detalhes e explicações…….por favor!!!
achei otimo explica mto bm
perfeito, gostei muito do seu resumo !
sou biólogo e n químico, to achando mto resumido, mas em td caso ”vou na sua”…
Estudando para a prova aqui!!! ótimo!! 🙂
faltou o modelo atual!!
O pouco que entendi, foi bom perder o meu tempinho.
É muito legal passar o tempo lendo e aprendendo as matérias de Química